脑声常谈丨啮齿动物焦虑情绪相关行为评价范式

目前对焦虑障碍及其发病机制的研究表明,焦虑障碍是环境和遗传因素共同作用的结果,涉及神经和内分泌等多个系统共同的作用。临床研究表明,不同类别焦虑障碍存在不同的神经生物学基础,很难为特定的焦虑障碍指定特定的动物模型,单个模型往往只能反映焦虑的某一个方面或焦虑障碍的某一类型。以往各方面研究均表明,单一焦虑模型不足以全面评价药物抗焦虑的作用,更为适合的评价方式是选择一组模型对应一类焦虑障碍,以下是可测量焦虑情绪水平的动物模型。
非条件化焦虑模型
非条件化焦虑模型基于动物对无明确疼痛或不适的压力或刺激的自然或自发反应。这些模型也可以用来测量焦虑情绪的水平,因此也可以称之为“实验(test)”。根据动物的行为方式,可以分为行为性实验、社会行为实验、恐惧行为实验和其他行为实验4类。
1行为性实验这一类模型基于啮齿动物天性中对新环境的探究习性和回避空旷、敞开的明亮空间的习性冲突建立,也称为趋近-回避冲突模型。
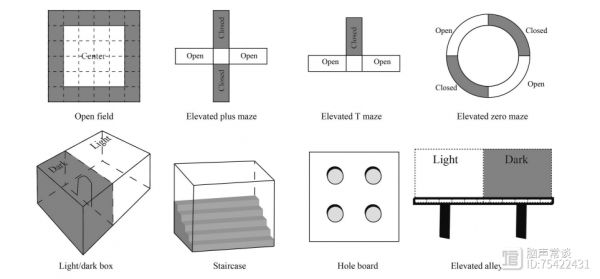
1934年首次建立,是动物心理学中最常用的实验之一,通过动物与群体的分离和对陌生空旷环境的恐惧冲突造成焦虑行为。旷场饮水实验是旷场实验的变体,通过动物对新异环境的恐惧和对中央区的饮水或进食等动机形成冲突状态。小鼠常用28cm×28cm至55cm×55cm的正方形敞箱(底部划分为面积相等的若干方格);大鼠使用正方形(100cm×100cm×50cm,底部划分为面积相等的若干方格)或圆形敞箱(直径80cm,高30cm,中央区为直径35cm的圆圈)。敞箱上方照明或使用透明底下方照明,也可使用红光照明。旷场饮水实验在箱中央倒置悬挂一水瓶,瓶嘴离地面10cm。动物按设计给药一定时间后置于中央区,令其在敞箱中自由活动一定时间(通常为5~10min),由顶部摄像机捕捉动物的活动,统计动物总活动次数、进入中央区的次数和停留时间,抗焦虑药物在不改变总运动和探索行为的前提下增加动物在中央区的活动和停留时间。对旷场饮水实验,前3天大鼠限制饮水,每天仅15∶00~16∶00给予饮水1h,同样给药后置于中央区,自由活动5~10min观察动物开始饮水的潜伏期、饮水时间、靠近水瓶的次数、站立数、排便和排尿次数等指标,低焦虑水平的动物具有较长的中央区域的饮水时间。
3高架十字迷宫实验高架十字迷宫实验是最常用的焦虑动物模型,由于开臂和外界相通,对动物来说具有新奇性的同时又具有一定威胁性,因此高焦虑水平的动物会退缩到闭臂中,低焦虑水平动物则在开臂停留更多的时间,对开臂的探究次数也增多。该模型对抗焦虑药和致焦虑药均敏感,但仪器差异、实验过程和动物品系均可能影响结果的重现性。装置由两个开臂和两个闭臂呈十字交叉状组成。大鼠迷宫开闭臂均长50cm,宽10cm,闭臂高30~40cm,交叉区域形成长宽均为10cm的中间平台,装置离地面50cm。小鼠迷宫开闭臂均长30cm,宽5cm,闭臂高15.25cm,中央平台长宽均为5cm,装置离地面40cm。实验开始前,动物按设计给药一定时间后在敞口动物盒内任其自由活动5min,立即置于高架十字迷宫的中央平台处,头朝固定的某一开臂,用摄像头记录5min动物的活动轨迹。分别统计各组动物进入开臂、闭臂的次数和停留时间,以及进入闭臂的潜伏期。同时计算进入开臂次数和时间占总入臂次数和时间的百分比,进行统计分析。高焦虑水平的动物在开臂停留的次数和时间显著低于低焦虑水平的动物。
4高架T迷宫实验T迷宫由高架十字迷宫改进而来。大鼠迷宫三臂各长50cm,宽12cm,离地50cm。闭臂高40cm,与两个开臂垂直,开臂两侧设有1cm高的边缘防止跌落。小鼠迷宫结构相似,臂长30cm,宽5cm,闭臂高15cm,开臂高1cm,离地38.5cm。T迷宫可以通过不同实验程序分别评价抗焦虑和抗惊恐药物。回避反应实验(avoidance)用于评价抗焦虑药物:大鼠给药后一定时间放入迷宫闭臂,面朝开臂,记录其从放入迷宫到四足全部进入开臂的时间,作为潜伏期基线;取出该动物,间隔30s再次放入闭臂,记录其四足全部进入开臂的时间为回避反应潜伏期1,再次取出该动物并间隔30s放入,记录其四足全部进入开臂的时间为回避反应潜伏期2。小鼠实验与大鼠类似,但放入检测的次数增加到5次,即记录5个回避反应潜伏期。逃避反应实验(escape)用于评价抗惊恐药物:动物给药后一定时间放入开臂面朝固定的某一闭臂,记录其从放入迷宫到四足全部进入闭臂的时间为逃避反应潜伏期。对比组间动物反应潜伏期,抗焦虑药物可以缩短回避反应的潜伏期,抗惊恐药物可以延长逃避反应潜伏期。
5圆形迷宫/O迷宫实验O迷宫是在高架十字迷宫基础上的改进,由一个环形区域构成,四等分交替分为开臂和闭臂,以避免动物停留于中心区既不属于开臂也不属于闭臂的现象。大鼠O迷宫为黑色硬质塑料制成的内直径105cm的圆环迷宫,跑道宽10cm,等分为四份,闭臂两侧设有高27~40cm的侧壁,开臂两侧高1cm,防止动物掉落。小鼠O迷宫与大鼠O迷宫类似,内直径30cm,跑道宽5cm。实验方法和评价指标同高架十字迷宫实验,但动物放置于O迷宫的开闭臂交界处,头朝固定的某一开臂。
6明暗箱实验利用动物对明亮地方具有天然的厌恶和好奇倾向建立。明暗箱尺寸为44cm×21cm×21cm,暗箱占1/3,顶部加盖避光,明箱占2/3,顶部亮光照明。两箱之间的隔板底部有一个12cm×5cm或7.5cm×7.5cm的门洞供动物穿过。动物给药后一段时间,在敞口动物盒中自由探究10min后将其立即置于明箱中央,背对洞口,记录5~10min内动物的活动行为。统计动物进入暗箱的潜伏期,穿箱次数,在明暗箱的滞留时间,进入明箱次数和时间占总次数和停留时间的百分比。高焦虑水平的动物的潜伏期、进入明箱次数和时间显著低于低焦虑水平的动物。
7爬梯实验基于啮齿类动物进入新异环境时通常感到紧张不安,表现为警觉和活动增加建立。实验使用有机玻璃箱,长45cm、宽10cm,一端高12.5cm、另一端高25cm,箱内有5级高2.5cm、宽10cm的相同楼梯,保证动物在楼梯内都有相同的站立条件。实验时环境安静、光线恒定,将小鼠置于箱的底部,使其背朝楼梯,记录3min内小鼠在楼梯上站立数(两前肢完全脱离地面计为一次)和攀爬上阶梯的级数(四肢都停留在阶梯上才算为一级,忽略下阶梯的级数)。以动物的爬梯数作为评价动物探究行为或活动性的指标,而站立数则作为动物焦虑状态的参数。抗焦虑药物在不减少爬梯数的同时使站立数减少。
8孔板实验该实验由Boissier等于1962年首次建立,动物的反复钻头行为反映了动物的新奇感与逃避的冲突行为。小鼠实验箱为40cm×40cm×27cm的敞箱,盒底均匀分布有4个直径为3.0cm的圆孔,每个孔内壁光滑,孔中心距离邻近的两个壁的距离为10cm;大鼠实验箱为66cm×56cm×47cm,圆孔直径为3.8cm。实验时将给药后的动物单独放置于实验箱孔板中央,记录5min内的活动行为,包括钻头次数和时间(以动物把头部伸入孔中直到双肩低于板平面时为一次;在一个圆孔探究一次后,不离开该圆孔而继续探究该孔的次数不计入,离开该孔后重新回来探究,算作另一次)和自主活动(动物在实验箱内水平活动的时间)。抗焦虑药物在不影响动物自主活动的同时,增加钻头次数和时间。
9高架小径实验(Suok实验)由Kalueff等在2005年基于经典的趋近-回避理论建立,动物在高架平衡木上活动同时受到高度(同时被保持平衡加强)和新环境的威胁,表现出对压力敏感的自发探究活动和平衡能力的变化。小鼠使用长2~3m,直径2~3cm,离地20cm的光滑铝管或铝棒,正中20cm区域为中央区;大鼠使用240cm×5cm×1cm的铝制“小径”或直径5cm的裹有海绵的金属/塑料棒,离地20cm,正中30cm区域为中央区。常规Suok实验在普通照明条件下进行;明暗Suok实验在暗室中进行,在一半装置上方50cm处悬挂4~6个45~60W灯泡。动物在给药一定时间后至于中央区自由活动5~10min,由摄像机捕捉动物的行为。记录动物的水平探索(离开中央区,跨越分区,移动距离和时间,不动时间等)、垂直探索(直立,靠墙行为)、定向探索(钻头,侧视)、风险评价行为(伸展姿势)和植物性神经反应(排便潜伏期,粪便数量,排尿点)。在常规Suok实验中,焦虑动物的探索活动减少,在明暗Suok实验中,焦虑动物进入明亮区域的时间和在明亮区域内移动的距离均减少。
社会行为实验
社会行为模型基于动物的社会活动行为建立。
1群居接触实验本方法为1970年代末期File和Hyde建立,基于孤养大鼠在陌生的环境相互表现出渴望接触的动机,但又对陌生环境和强光条件产生恐惧形成的矛盾冲突状态,表现为正常的主动接触行为受到抑制。一般采用雄性大鼠单笼饲养7日以上,实验时按体重随机编成成对小组(体重一般相差不超过15g),给药后放回原笼。动物彼此不熟悉条件下,将配对两只大鼠对角同时放入60cm×60cm×35cm的敝箱。分别测定10min内配对大鼠在强光(350流明左右)和弱光(30流明左右)下的主动接触累积时间(s),主动接触包括:嗅、舔、追尾、抓、咬、踢、打等行为动作,而被动的依靠则不计入在内。实验后将大鼠单个放在箱内,使之在自然光的条件下每天熟悉实验箱10min,连续2天。接下来进行强光和弱光熟悉实验,观察时间和指标与第一阶段相同。未经药物处理的大鼠,其主动接触时间在弱光熟悉多于强光不熟悉,而强光熟悉与弱光不熟悉则介于两者之间。不同类型的抗焦虑药物在此模型上的表现不完全相同。如:BDZ类药物增加强光或不熟悉环境下大鼠的主动接触时间,而在弱光熟悉条件下的作用极小;巴比妥类药物则在4种条件下都使主动接触增多。
2分离诱导超声波实验啮齿类动物可以发出并探测超声波用于交流,其频率与动物的情绪相关。幼年大鼠出生后前14天内,在与母亲、同巢幼崽或巢穴分离时会发出超声波,该反应在幼崽出生6~12天内最强,可作为焦虑模型用于抗焦虑药物评价。实验使用出生后9~11天的幼鼠,保持室温25±1℃。实验前与母鼠正常合养,实验当天,幼鼠腹腔给药后放回原笼,按设计在一定时间后依次取出幼鼠,放入隔音箱内的20cm×20cm×17cm有机玻璃箱或铺有滤纸的500mL烧杯中并关闭隔音箱,记录5min内幼鼠发出20~60kHz之间超声波的发声次数,超声记录结束后记录动物的直肠温度。抗焦虑药物在不影响动物直肠温度的前提下减少动物的发声次数。
3期待性焦虑实验基于实验动物在应激下体温升高的现象建立,该现象也在人类存在。当群居小鼠被从笼中依次取出时,最后一只小鼠出现直肠温度升高的现象,是动物对反感事件的期待性焦虑造成,可以被提前给予的抗焦虑药物抑制。雄性小鼠在实验环境中适应饲养至少7天以后随机分组,每笼18~20只,按设计给药一定时间后,逐一取出小鼠测温。只记录前3只和最后3只的体温。探头伸入的长度和停留的时间保持一致。计算后3只和前3只动物的体温平均值之差作为体温的升高值。空白对照的升高值一般为1.1~1.3℃。
恐惧行为实验
1僵住行为实验基于啮齿类动物在遭受厌恶刺激时会产生僵住的防御性行为建立。实验使用动物操作箱,底部金属栅栏,带有电击控制器。雄性大鼠给药后适当时间单独放入操作箱内任其自由探究2min。然后给予0.5mA、0.5s电击,2~2.5min后再次电击,进行观察,记录动物的僵住时间、小范围探究活动时间(仅躯体和前肢活动)、活动时间(后肢活动、理毛、站立)和站立次数。
2听觉惊跳反应实验突然的声音刺激会引起哺乳动物的惊吓反应。惊跳反应系统包括小笼(大鼠8cm×8cm×16cm,可以限制其活动但不致束缚)、扬声器和压力感受器,置于隔音箱中。动物置于小笼内适应50分贝(dB)白噪声5min,实验噪声为98或124dB,持续20ms,并测定动物200ms内压力变化,各噪声随机重复12次,间隔20~40s(同样随机),给药后再次以上述程序随机测定。每次刺激后200ms内最大重量变化为惊恐峰值,每个刺激的12个峰值取均值。动物给药前作为对照,结果以给药后的均值占给药前均值的百分比表示。
其他行为模型
1新奇抑制摄食实验1988年由Bodnoff等基于动物的吞噬行为建立,禁食动物在新环境里会产生类似焦虑的冲突反应。大鼠使用76cm×76cm×46cm至100cm×100cm×40cm的敞箱,底部铺有一层锯末(每只动物更换),中央区摆有30个同样大小的食丸或一定重量的食物,中央区有强光照明。小鼠使用较小的敞箱(如50cm×50cm×20cm)和较少的食物。使用雄性动物,测试前给药一至多次,实验前动物禁食48h后头朝外放入敞箱并开始计时,直到动物开始咀嚼食物而不是摆弄食物,记为摄食的潜伏期,记录5~10min内动物的摄食量。以摄食潜伏期和摄食量判断药物的抗焦虑作用,抗焦虑药物使动物的摄食潜伏期缩短,摄食量增加。
2咬木塞实验本模型基于啮齿动物的啃咬习性,由Pollard和Howard于1991年首次报道。该方法对丁螺环酮类药物敏感,因此有独到的价值。实验使用底部带金属丝网的不锈钢笼具,大小为17cm×18cm×24cm;11号软木塞,重2~3g。实验使用雄性大鼠,每天上午单独与一个软木塞放入笼具训练30min,每周训练5天,训练30次至软木塞丢失量(精确至0.01g)稳定后开始给药实验,记录给药前数日的丢失量和给药后的实验日丢失量,以给药前数日的丢失量均值为基线,与给药后的实验日丢失量比较进行计算。

条件化焦虑模型

条件化焦虑模型考察动物对条件化(且往往是疼痛,例如电击)刺激的焦虑行为反应。
1操作条件冲突实验操作条件冲突实验指包含学习/惩罚反应的焦虑动物模型,通常使用斯金纳箱,也称条件操作箱,尺寸一般为30cm×22cm×27cm,放在隔音箱中,箱中有通风和摄像头。底部为与电刺激器相连的不锈钢栅栏,上方照明,一侧装有1只扬声器和2个刺激灯,其下方5cm处各有1个不锈钢水平压杆用于动物获得食丸。
由Geller和Seifter建立,通过给饥饿大鼠食物奖赏的同时给予电击刺激,使大鼠处于矛盾冲突状态。实验使用连接微机的斯金纳箱,选用健康雄性大鼠,体重250~300g。首先,设置程序训练大鼠,经典Geller-Seifter程序由变动间期(variable interval,VI)和固定比率(fixed ratio,FR)两部分组成。先对大鼠进行VI-2min训练,每日训练大鼠至平均每2min的间隔获得一次食丸;之后变为FRl,即在VI内的每个15min内给予3min的声刺激。大约再过7个训练间期(7天),在声刺激同时给予电击(电击强度为0.6~0.85mA),即在声音出现时每次压杆产生一次强化和一次电击。程序可缩写为“组合VI-2min(食)+FR1(食+电击)”,FR1称为冲突部分。分别记录FR和VI期动物压杆数。抗焦虑药物增加FR期压杆次数,而不影响VI期反应;VI期压杆反应次数的降低可能与药物的镇静作用有关。
3安全信号撤除实验此实验基于在经过训练、与安全信号建立了条件反射的大鼠,在安全信号消失后会产生焦虑的原理建立。实验分训练和实验两个阶段。训练阶段大鼠禁食24h,每天训练18min,约12天内学会从FR1到FR8的压杆强化操作,期间保持右灯亮(安全信号),压右杆给予食丸,压左杆无反应。12天后在第4min和第11min分别加入4min的电击惩罚期,期间左灯亮(惩罚信号),压右杆给予食物强化同时按50%的随机比率给予不超过9次的电击,并逐渐增加强度至每只大鼠产生类似的反应抑制(0.5~1.5mA),记录大鼠获得的食丸数和电击数。大约20个训练间期后所有大鼠都表现出稳定的非惩罚和惩罚反应速率,此时开始药物实验。实验间期共11min,1段(4min)和3段(3min)为FR8非惩罚期,右灯亮(安全信号);2段(4min)左右灯均关闭(安全信号撤除),室灯亮,按FRl给予强化但不加电击,记录各段动物的压杆强化数。抗焦虑药在不增加1、3段强化数的剂量下增加2段的强化数。
4戊四氮鉴别刺激实验五甲烯四氮唑,即戊四氮(pentylenetetrazol,PTZ)是一种GABA受体拮抗剂和致焦虑剂,广泛应用于动物焦虑模型的建立。本模型通过固定比率食物强化程序使动物对PTZ和某个特定的条件(如正确压杆或钻洞)建立条件反射,并不断强化,形成PTZ辨别,抗焦虑药物可以使动物PTZ判别正确率下降。实验装置为斯金纳箱或钻洞触鼻训练箱。雄性大鼠单笼饲养,禁食至体重下降20%并保持控制食物使体重维持在这一水平,开始进行压杆奖赏实验,给予戊四氮20mg·kg-1后,动物压A杆有食丸奖赏,B杆不给奖赏;注射生理盐水则反之。每天进行一次5min训练,随机给予戊四氮或生理盐水,但连续给同一刺激不超过2次;最终使动物能够完成连续8次的正确辨认(所注射的是生理盐水或是戊四氮),进入测试阶段。给药后每2天进入训练箱1次,当天提前1h给予受试药物或溶剂对照,之后腹腔注射戊四氮或生理盐水,观察动物的压杆行为。记录测试阶段动物压杆的正确和错误行为次数,给予抗焦虑药物的动物压错杆才记为正确行为,连续4次正确行为可以认为受试药物具有抗焦虑活性。每只动物统计是否体现抗焦虑活性。
5Vogel饮水冲突实验由Vogel等于1971年建立的非操作条件冲突实验,主要利用禁水动物饮水时受到电击的恐惧形成矛盾状态,抗焦虑药物会使惩罚期舔水次数增多。实验箱为45cm×24cm×21cm的有机玻璃箱,底部为不锈钢栅栏,顶部为不锈钢网盖,插入绝缘的带有不锈钢嘴的水瓶,水瓶和底部栅栏一起通过导线与刺激-记录仪相连。实验分两阶段进行。第一阶段为训练期,动物禁水24h后被单独置于操作箱,直到发现瓶嘴并开始舔水,计数器自动记录其在3min内的舔水次数,对舔水少于300次的动物予以淘汰;第二阶段为惩罚期,将未被淘汰的动物继续禁水24h后给药,再次单独置于操作箱,动物舔水20次起仪器自动开始计时并给予一次电击(舔水与电击次数之比为20∶1),电击强度一般为0.2~0.5mA,持续2s,但动物可通过脱离瓶嘴来解除电击。记录3min动物的舔水次数和电击次数。也可以通过多次饮水电击造成焦虑模型。
6电击探头埋藏实验也称为条件性防御掩埋模型,基于动物对恐惧刺激产生的防御反应建立,该反应不需要训练,经历一次电击即可出现。一些神经松弛剂也表现出阳性效果,但抗焦虑药物仅在低电流时有效,神经松弛剂在电流较高(如10mA)时仍有效。实验使用40cm×40cm×30cm有机玻璃盒,底部均匀覆盖5cm厚垫料。四壁安装有4个电击探头(长6.5cm,直径0.5cm),均高于垫料2cm,电流设为1~2mA,盒上方连接摄像头用于观察。实验前,每天将大鼠5~6只为一组放入实验盒适应30min,共适应4天。实验当日给药后适当时间,大鼠单独放入实验箱中央,背对电击探头,待动物第一次接触探头被电击后开始计时15min,探头保持充电。记录大鼠被电击后15min内掩埋动作的持续时间、电击的总次数、动物的不动时间(定义为大鼠除了呼吸外身体完全不动)和电击反应行为评分。评分标准为:1分=只有头或前爪退缩,2分=全身退缩,包括/不包括缓慢远离探头,3分=全身退缩及立即远离探头,包括/不包括跳跃,4分=全身退缩和跳跃(四爪离地)并立即逃向实验箱对侧。
7小鼠四板实验四板实验以被动回避为基础,小鼠渴望探究,但又因害怕足部电击而使探究活动受到抑制,抗焦虑剂可缓解或解除这种抑制状态,使小鼠电击次数增多。实验使用25cm×18cm×16cm的长方形箱,底部有4块8cm×11cm的金属板,各板间均有4mm宽的间隙,均与电刺激器相连,电流强度为0.2~0.8mA,处于对角线的2块板同极,使小鼠每当跨越上下或左右金属板时受到一次电击。给药后一定时间将小鼠置于板上,让其探究15s后打开电刺激器。当小鼠受到电刺激时产生明显的逃避反应,通常穿过2块到3块板便会停下,计为1次。如小鼠继续移动,3min内不予电击;如小鼠不停移动则予以淘汰。记录10min内每分钟的电击数。
8应激诱导超声波啮齿动物在面对厌恶事件,如电击、与同窝幼仔分离、固定尾部和冷板等时发出超声波,这一反应不会被止痛类药物抑制,可以用于抗焦虑药物的评价。与分离发声实验不同,电击等应激条件下的超声发声实验属于条件化焦虑模型。实验使用连接有超声测量仪器的隔音箱。使用200g左右的青年雄性Wistar大鼠,适应环境饲养7天以上。在训练期,每只大鼠每天单独放置于隔音箱中接受电击或天敌暴露、社交失败、声音惊吓和慢性温和应激等刺激,经过一段时间的训练(如电击5天),最后一次应激后立即记录超声波5min。连续两天发出超过150s超声波的动物为造模成功,可用于后续的药效评价。统计动物发出超声波的时长(s)和平均发声水平(以测试期间的超声信号平均值表示),抗焦虑药物能够剂量依赖地减少超声波时长和平均发声水平。

其他条件性焦虑实验

其他条件性焦虑模型包括条件恐惧实验和条件味觉厌恶等。条件恐惧实验基于巴普罗夫的条件反射建立,如条件性情绪反应,将较弱刺激通过训练与厌恶刺激建立条件反射,在没有刺激的情况下测量动物的行为,以评价其焦虑或恐惧的强度;恐惧增强惊跳实验因不测量对焦虑或恐惧的抑制状态,而是考察对象对训练场景的惊跳反射变化,目前在PTSD研究中较为常用。条件性味觉厌恶是味觉刺激与不适内脏刺激导致的厌恶情绪之间的条件反应,抗焦虑药物可以对抗通过训练建立起的条件厌恶反应。这两类实验目前在焦虑药物的临床前评价中应用较少。
文献引用: 1.Hypothalamic-pituitary-thyroid (HPT) axis functioning in anxiety disorders. A systematic review.[J]. Fischer Susanne;;Ehlert Ulrike.Depression and anxiety,20182.GABA-modulating phytomedicines for anxiety: A systematic review of preclinical and clinical evidence.[J]. Savage Karen;;Firth Joseph;;Stough Con;;Sarris Jerome.Phytotherapy research : PTR,20183.兰嘉琦,赵春阳,吴镭,等.抗焦虑障碍药物非临床药效学评价体系探索[J].药学学报,2021,56(04):949-965.DOI:10.16438/j.0513-4870.2020-1569.4.A standardization of the Novelty-Suppressed Feeding Test protocol in rats[J]. Arantxa Blasco-Serra;;Eva M. González-Soler;;Ana Cervera-Ferri;;Vicent Teruel-Martí;;Alfonso A. Valverde-Navarro.Neuroscience Letters,20175.Agmatine attenuates chronic unpredictable mild stress-induced anxiety, depression-like behaviours and cognitive impairment by modulating nitrergic signalling pathway[J]. Nitin B. Gawali;;Vipin D. Bulani;;Malvika S. Gursahani;;Padmini S. Deshpande;;Pankaj S. Kothavade;;Archana R. Juvekar.Brain Research,20176.Behavioral methods to study anxiety in rodents.[J]. Lezak Kimberly R;;Missig Galen;;Carlezon William A.Dialogues in clinical neuroscience,20177.The psychopharmacological activities of Vietnamese ginseng in mice:characterization of its psychomotor, sedativeehypnotic, antistress, anxiolytic, and cognitive effects[J]. Irene Joy I. dela Peña;;Hee Jin Kim;;Chrislean Jun Botanas;;June Bryan de la Peña;;Thi Hong Van Le;;Minh Duc Nguyen;;Jeong Hill Park;;Jae Hoon Cheong.Journal of Ginseng Research:Journal of Ginseng Research,20178.Anxiety Disorders Among Women: A Female Lifespan Approach.[J]. Hantsoo Liisa;;Epperson C Neill.Focus (American Psychiatric Publishing),20179.Noise Annoyance Is Associated with Depression and Anxiety in the General Population- The Contribution of Aircraft Noise.[J]. Beutel Manfred E;;Jünger Claus;;Klein Eva M;;Wild Philipp;;Lackner Karl;;Blettner Maria;;Binder Harald;;Michal Matthias;;Wiltink Jörg;;Brähler Elmar;;Münzel Thomas.PloS one,201610.Sex differences in anxiety disorders: Interactions between fear, stress, and gonadal hormones[J]. Lisa Y. Maeng;;Mohammed R. Milad.Hormones and Behavior,201511.Resolving the neural circuits of anxiety.[J]. Calhoon Gwendolyn G;;Tye Kay M.Nature neuroscience,201512.Animal models for screening anxiolytic-like drugs: a perspective.[J]. Bourin Michel.Dialogues in clinical neuroscience,201513.Genetics of anxiety disorders: Genetic epidemiological and molecular studies in humans.[J]. Shimada-Sugimoto Mihoko;;Otowa Takeshi;;Hettema John M.Psychiatry and clinical neurosciences,2015
14.The GAD65 knock out mouse - a model for GABAergic processes in fear- and stress-induced psychopathology.[J]. Müller Iris;;Çalışkan Gürsel;;Stork Oliver.Genes, brain, and behavior,2015
15.Hormonal changes and increased anxiety-like behavior in a perimenopause-animal model induced by 4-vinylcyclohexene diepoxide (VCD) in female rats[J]. FMCV Reis;;N Pestana-Oliveira;;CM Leite;;FB Lima;;ML Brandão;;FG Graeff;;CM Del-Ben;;JA Anselmo-Franci.Psychoneuroendocrinology,2014
16.Strain differences in the chronic mild stress animal model of depression and anxiety in mice.[J]. Jung Yang-Hee;;Hong Sa-Ik;;Ma Shi-Xun;;Hwang Ji-Young;;Kim Jun-Sup;;Lee Ju-Hyun;;Seo Jee-Yeon;;Lee Seok-Yong;;Jang Choon-Gon.Biomolecules & therapeutics,2014
17.FG7142, yohimbine, and βCCE produce anxiogenic-like effects in the elevated plus-maze but do not affect brainstem activated hippocampal theta[J]. Michelle Yeung;;Lily Lu;;Adam M. Hughes;;Dallas Treit;;Clayton T. Dickson.Neuropharmacology,2013
18.Animal models of anxiety: A comprehensive review[J]. Vijender Kumar;;Zulfiqar Ali Bhat;;Dinesh Kumar.Journal of Pharmacological and Toxicological Methods,2013
19.Animal models of anxiety disorders and stress.[J]. Campos Alline C;;Foga?a Manoela V;;Aguiar Daniele C;;Guimar?es Francisco S.Revista brasileira de psiquiatria (Sao Paulo, Brazil : 1999),2013(supp)
20.Allopregnanolone regulates neurogenesis and depressive/anxiety-like behaviour in a social isolation rodent model of chronic stress[J]. Jane Evans;;Yuhui Sun;;Ailsa McGregor;;Bronwen Connor.Neuropharmacology,2012
21.Chronic social defeat stress model: behavioral features, antidepressant action, and interaction with biological risk factors.[J]. Venzala E;;García-García A L;;Elizalde N;;Delagrange P;;Tordera R M.Psychopharmacology,2012
22.Global prevalence of anxiety disorders: a systematic review and meta-regression[J]. A. J. Baxter;;K. M. Scott;;T. Vos;;H. A. Whiteford.Psychological Medicine,2012
23.Anxiety and depression after cancer diagnosis: Prevalence rates by cancer type, gender, and age[J]. Wolfgang Linden;;Andrea Vodermaier;;Regina MacKenzie;;Duncan Greig.Journal of Affective Disorders,2012
24.Diazepam-induced decrease in anxiety-like behaviors of marmoset monkeys exposed to a novel open-field[J]. Priscila Cagni;;Mara Komorowski;;Gabriela C. Melo;;Talita Lima;;Marilia Barros.Pharmacology, Biochemistry and Behavior,2012
Animal models of anxiety and anxiolytic drug action.[J]. Treit Dallas;;Engin Elif;;McEown Kris.Current topics in behavioral neurosciences,2010
25.Nicotine Withdrawal Increases Threat-Induced Anxiety but Not Fear: Neuroadaptation in Human Addiction[J]. Joanne M. Hogle;;Jesse T. Kaye;;John J. Curtin.Biological Psychiatry,2010
26.Chemical Models of Anxiety: Evidence for Diagnostic and Neurotransmitter Specificity[J]. Thomas W. Uhde;Manuel E. Tancer;George N. M. Gurguis.International Review of Psychiatry,2009
27.Chronic social defeat downregulates the 5-HT1A receptor but not Freud-1 or NUDR in the rat prefrontal cortex[J]. Niamh Kieran;;Xiao-Ming Ou;;Abiye H. Iyo.Neuroscience Letters,2009
28.The regular and light-dark Suok tests of anxiety and sensorimotor integration: utility for behavioral characterization in laboratory rodents.[J]. Kalueff Allan V;;Keisala Tiina;;Minasyan Anna;;Kumar Senthil R;;LaPorte Justin L;;Murphy Dennis L;;Tuohimaa Pentti.Nature protocols,2008
29.Acute corticosterone treatment is sufficient to induce anxiety and amygdaloid dendritic hypertrophy.[J]. Mitra Rupshi;;Sapolsky Robert M.Proceedings of the National Academy of Sciences of the United States of America,2008
30.Evaluation of the analgesic effect of alkaloid extract of Peganum harmala L.: possible mechanisms involved.[J]. Farouk Loubna;;Laroubi Amine;;Aboufatima Rachida;;Benharref Ahmed;;Chait Abderrahman.Journal of ethnopharmacology,2008

找实验方法,上脑声常谈


重点推荐
**《指南》,上脑声工房
方法检索教程
相关知识
脑声常谈丨啮齿动物社交情绪相关行为范式总结
脑声常谈发布动物行为在线分析网站 为学术研究提供全新工具
脑声问答期丨动物享乐型摄食行为如何测试?
脑声常谈丨基于社会接触的啮齿动物共情行为
脑声问答期丨动物攻击行为范式及顺序选择
脑声问答期丨如何测试评价大小鼠的甩头行为?
脑声问答期丨动物疼痛和焦虑抑郁共病如何交叉评估?
脑声常谈:啮齿动物孤独症模型及评价
脑声常谈:哪些经典的动物神经行为学实验用于评价药理毒理研究(八臂迷宫)
【脑声常谈】动物行为实验指南:小鼠视觉行为测试之黑白箱实验
网址: 脑声常谈丨啮齿动物焦虑情绪相关行为评价范式 https://m.mcbbbk.com/newsview216372.html
| 上一篇: 了解猫咪分离焦虑,这些症状与原因 |
下一篇: 小狗一般喂什么食物 |
