检测宠物源性人兽共患病的多重PCR引物探针及试剂盒的制作方法
本发明涉及分子生物学领域,特别是涉及用于检测汉赛巴尔通体、刚地弓形虫,布鲁氏菌这三种宠物源性人兽共患病的荧光定量pcr引物和探针及试剂盒。
背景技术:
随着人们生活水平的提高,城市宠物数量猛增。宠物已逐渐成为许多家庭的一个重要部分,甚至以家庭成员相待,与人类接触甚为密切。但是,宠物给人们的生活带来乐趣的同时也给人们带来了难以察觉的隐患。威胁着人类的健康。宠物疫病的控制已成为国际社会共同关注的问题之一。猫和犬是目前国内最常见的宠物,据不完全统计与宠物犬、猫有直接或间接关系的达70多种。这些人兽共患病原通过宠物生理性的呼吸、唾液,病理表现如咳嗽、流鼻涕、呕吐、腹泻等或者日常接触中的不经意抓挠,直接或者间接的传染给人类。尤其老人、孕妇和儿童是最易感染的群体。
其中在猫或者犬中携带率较高,感染症状较为隐匿不易被发现,但是感染人后可引起严重疾病的几种人畜共患病有弓形虫病、猫爪病以及布病。其中弓形虫病是由刚地弓形虫引起的一种严重的人兽共患病。弓形虫眼病、肝病的临床报道屡见不鲜,甚至可以引起弓形虫脑病,更是免疫功能低下和免疫功能缺陷者最为常见的感染来源和死亡原因之一。孕妇感染可以导致胎儿畸形、流产、死胎等不良孕产结果,是计划生育、优生优育的大敌。猫爪病是由汉赛巴尔通体引起,传染源主要是带菌的猫,常见与在1岁以下的小猫,犬类也可携带病原,成为传染源。病原体存在于宠物的口咽部,宠物受染后可形成菌血症,并可通过身上的跳蚤在猫群中传播,故猫的带菌率相当高。有报道宠物猫的感染率达40%。人通常是在被猫或者犬抓伤、咬伤或与猫密切接触后而感染。据报告,全球每年猫抓病的发病人数超过4万例,以青少年和儿童居多。布病由布鲁氏杆菌属的细菌引起的人与多种动物共患的慢性传染病。带菌患犬是最主要传染源,猫也可携带病原成为传染源。宠物多呈隐性感染,最危险的传染源是受感染的怀孕母犬,分娩或流产时排出大量病原菌,甚至乳汁中都含有该菌。经口感染是主要的传播途径,经皮肤感染也较常见,不仅可损伤皮肤,亦可由健康皮肤侵入机体而致病,呼吸道也可感染此病。
面对严重威胁人类安全与发展的人畜共患病,相对于个人的自我防护,更为重要的是对各种人畜共患病进行控制,做到早发现、早报告、早处理,严格防止某些疾病的暴发和传播。提高诊断技术,要把此病有效地控制在侵袭人类之前。要认识到防控此病中动物所起的重要作用,更要认识动物卫生和疫病的控制的重要性,所以要有效地控制源头,人类的病也就控制了。既然知道了此病防控中人和动物的位置同等重要,就要提高疫病诊断能力,开发相关诊断试剂盒。才能更有效地降低人畜共患病的发生和流行,防止由此给人类带来更大的灾难。
上述3种常见的宠物源性人兽共患病原体培养难度大、周期长、且危险性较大,不推荐使用病原培养作为检测的标准。目前,核酸检测技术凭借快速、高灵敏度和特异度的优势,越来越广泛的应用于弓形虫、巴尔通体及布病感染的实验室检测。国内外已报道相关病原体荧光pcr检测体系,检测灵敏度和特异度均超过传统的血清学检测和普通pcr检测技术。现有的实验室相关病原检测体系其检测灵敏度在几拷贝到几十个拷贝之间。目前已经有各自相关的核酸实验室检测技术报道,但方法基本局限在实验室检测层面,其检测方案基本也是独立的病原菌进行单独检测,且各自检测使用的具体方法、扩增试剂以及检测条件各不相同,无法进行整合。目前尚未有此三种重要人兽共患病病原同时检测的试剂盒。极大的增加了临床检测工作量和检测成本,降低了检测效率。因此,急需建立一种快速、灵敏、特异的检测技术来提高临床对汉赛巴尔通体、刚地弓形虫,布鲁氏菌的检测能力。
技术实现要素:
本发明的目的在于一种能同时检测3种宠物源性人兽共患病原(汉赛巴尔通体、刚地弓形虫,布鲁氏菌)的试剂盒和诊断试剂,以克服上述不足。
本发明通过对现有数据库中汉赛巴尔通体、刚地弓形虫以及布鲁氏菌(猪种、牛种、羊种、牛种4个高致病性种)基因组中特异性序列比对,找到高度保守的核苷酸序列,并以该序列为基础设计的具有更高灵敏度和特异度的三重荧光pcr方法。本发明首先提供一种适用于单反应同时检测宠物源性人兽共患病原的三重荧光pcr引物组合,所述宠物源性人兽共患病原为汉赛巴尔通体、刚地弓形虫,布鲁氏菌;其中检测汉赛巴尔通体的引物含有seqidno.1-2所示的核苷酸序列或其特异性序列;检测刚地弓形虫的引物含有seqidno.4-5所示的核苷酸序列或其特异性序列;检测布鲁氏菌的引物含有seqidno.7-8所示的核苷酸序列或其特异性序列。
本发明进一步提供了与所述三重荧光pcr引物组合配合使用的荧光探针组合,与检测汉赛巴尔通体的引物配合使用的探针含有seqidno.3所示的核苷酸序列或其特异性序列;与检测刚地弓形虫的引物配合使用的探针含有seqidno.6所示的核苷酸序列或其特异性序列;与检测布鲁氏菌的引物配合使用的探针含有seqidno.9所示的核苷酸序列或其特异性序列。
本发明进一步提供了一种检测宠物源性人兽共患病原的引物、荧光探针组合,含有上述的三重荧光pcr引物组合和上述的荧光探针组合。
本发明提供了所述的三重荧光pcr引物组合和荧光探针组合在制备汉赛巴尔通体、刚地弓形虫,布鲁氏菌的检测试剂盒或诊断试剂中的应用。
本发明提供一种试剂盒,该试剂盒含有所述的三重荧光pcr引物组合和/或所述的荧光探针组合。
进一步地,本发明提供的试剂盒含有上述引物组合和荧光探针组合,该试剂盒可以采用荧光定量pcr单反应同时检测汉赛巴尔通体、刚地弓形虫,布鲁氏菌。
本发明提供的上述试剂盒在检测汉赛巴尔通体、刚地弓形虫,布鲁氏菌这三种病原时,检测灵敏度分别达5、5、50个拷贝。
本发明提供的试剂盒中,优选地,所述荧光定量pcr的25μl反应体系为:
本发明试剂盒的工作条件为:95℃2min,1个循环;95℃15s,56℃-59℃30s,45个循环。
更进一步地,本发明提供了一种用于检测汉赛巴尔通体、刚地弓形虫,布鲁氏菌的三重荧光pcr体系,该体系初始含有核苷酸序列分别如seqidno.1-9所示的dna片段,通过荧光定量pcr实现对汉赛巴尔通体、刚地弓形虫,布鲁氏菌的检测。
本发明提供一种用于检测汉赛巴尔通体、刚地弓形虫,布鲁氏菌的诊断试剂,含有seqidno.1-2、4-5、7-8所示的引物组合和seqidno.3、6、9所示的荧光探针组合。
本发明提供的试剂盒或诊断试剂,还包括荧光定量反应液,阴性模板和阳性模板,所述阴性模板为无核酸酶水,所述阳性模板为汉赛巴尔通体、刚地弓形虫,布鲁氏菌基因组dna。
本发明提供的同时检测3种宠物源性人兽共患病原的试剂盒或诊断试剂是以三重荧光pcr方法为基础进行检测的,包括以样品总dna为模板,利用本发明提供的引物和探针进行实时荧光定量pcr,同时设立阴性对照和阳性对照,根据扩增曲线的ct值判定结果。
本发明试剂盒每次检测标本时必须设立neg对照(阴性对照)和pos对照(阳性对照),两种对照对于结果判读起决定性作用:
有效扩增:ntc(-)、neg(-)、pos(+);
无效扩增:ntc(-)、neg(-)、pos(-)提示试剂失效;
无效扩增:ntc(-)、neg(+)、pos(+)提示加样污染;
无效扩增:ntc(+)、neg(+)、pos(+)提示试剂盒污染。
只有对照有效扩增情况下的样品检测结果才可信,否则试验需要重复。
在检测中三种对照为有效扩增时,样本结果判断标准如下:
ct值小于等于38的标本为阳性结果;
ct值大于40的标本为阴性结果;
ct值在38-40之间的标本需要重复,重复试验如ct值依然低于40判定为阳性扩增,超过40判定为阴性扩增。
本发明针对三种常见的重要宠物源性人兽共患病病原的特异性基因的保守区域设计多重特异性探针和引物。共设计了6套相应的特异性检测探针和引物,通过实验室条件优化和筛选,以及探针引物相互组合,最终选定其中灵敏度高的一套体系,通过实验室条件优化,建立了单反应同时检测这三种病原的方法,简化了原有2/3以上的检测工作量,并缩短检测时间1小时左右。其中基于本发明提供的引物和探针组合建立的检测试剂盒对于汉赛巴尔通体的检测灵敏度为5个拷贝,;刚地弓形虫的检测灵敏度为5个拷贝;布鲁氏菌的检测灵敏度为50个拷贝。对临床常见23种病原体以及犬、猫染色体均无非特异扩增,显示出良好的特异度。经标准浓度梯度阳性核酸质粒定量检测,本发明的检测灵敏度优于已报道的三种病原检测体系,具有良好的标本检测能力。
附图说明
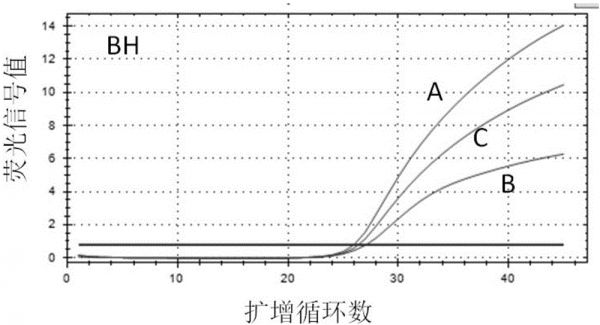
图1-图3分别为实施例1中针对汉赛巴尔通体(bh),刚地弓形虫(tg),布鲁氏菌(bru)三个病原设计的三套引物探针组合的荧光pcr扩增曲线图,图中abc分别指每个病原的三套编号为abc的引物探针组合对应的荧光pcr扩增曲线。
图4为本发明实施例2的三重荧光pcr扩增体系退火温度扩增曲线图。
图5为实施例3的23种常见病原及犬、猫染色体扩增均为阴性结果图。
图6为bh,tg,bru三重荧光pcr体系检测限。
图7为bh,tg,bru多重荧光pcr体系标准曲线,上、中、下图分别对应bh的标准浓度梯度模板荧光pcr标准曲线,tg的标准浓度梯度模板荧光pcr标准曲线,bru的标准浓度梯度模板荧光pcr标准曲线;图中1:5×106拷贝,2:5×105拷贝,3:5×104拷贝,4:5×103拷贝,5:5×102拷贝,6:50拷贝,7:5拷贝,8:空白对照。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1针对靶序列的引物探针设计
针对实施例扩增汉赛巴尔通体(bh),刚地弓形虫(tg),布鲁氏菌(bru)的靶序列,发明人设计了针对每种病原菌分别设计了3套检测体系a、b、c组(下表1),并对三套体系进行了比较和组合优化。
表1
对表1设计的针对3个病原的不同引物探针比较试验发现以下引物和探针组合荧光信号值稳定,扩增效果良好,见图1-图3,因此本发明确定该引物和探针组合为最佳用于荧光定量pcr检测汉赛巴尔通体(bh),刚地弓形虫(tg),布鲁氏菌(bru)的组合。
表1中bh检测a组bh-its-fcagcgtccatttggttgatataaa(seqidno.1)
bh-its-rgaaccgatagtttcatataggcattg(seqidno.2)
bh-its-ptccaaatgctcatagacg(mgb)(seqidno.3)
表1中tg检测b组tg-529-fgctcgcctgtgcttgga(seqidno.4)
tg-529-rgcgtctgtagtccccttcga(seqidno.5)
tg-529-pccacagaagggacagaa(mgb)(seqidno.6)表1中bru检测a组
实施例2多重荧光pcr检测实验参数的优化与方法建立
(1)体系退火温度优化:体系退火温度从55℃-65℃改变,结果显示退火温度为56-59℃体系扩增效果最好(见图4)。
(2)体系引物探针浓度优化:将体系引物(25μm)和探针(25μm)从0.1μl依次递增至0.5μl,每次增幅0.1μl,每个浓度梯度做3个平行样。结果bh-its体系上下游引物及探针为0.4、0.2、0.1μl,tg-529体系上下游引物及探针为0.4、0.2、0.1μl,bruspp-bcsp31体系上下游引物及探针为0.4、0.2、0.1μl时,体系扩增效果最好。
(3)体系镁离子浓度优化:将体系中mgcl2从0.5μl依次递增为6μl,每次增幅0.5μl,每个浓度梯度做3个平行样。结果mgcl2添加量为2.5μl(mgcl2终浓度为5mm)时体系扩增效果最好。
(4)荧光定量pcr扩增体系及扩增条件的优化结果
扩增条件:95℃预变性2min,1个循环;95℃变性15s,56-59℃退火30s,45个循环。
每次检测标本时必须设立ntc对照(无模板对照)、neg(阴性对照)和pos对照(阳性对照),三种对照对于结果判读起决定性作用:有效扩增:ntc(-)、neg(-)、pos(+);
无效扩增:ntc(-)、neg(-)、pos(-)提示试剂失效;
无效扩增:ntc(-)、neg(+)、pos(+)提示加样污染;
无效扩增:ntc(+)、neg(+)、pos(+)提示体系污染。
只有对照有效扩增情况下的样品检测结果才可信,否则试验需要重复。
在检测中三种对照为有效扩增时,样本结果判断标准如下:
ct值小于等于38的标本为阳性结果;
ct值大于40的标本为阴性性结果;
ct值在38-40之间的标本需要重复,重复试验如ct值依然低于40判定为阳性扩增,超过40判定为阴性扩增。
实施例3多重荧光pcr检测体系的特异度评价
用本发明实施例2优化了的多重荧光pcr方法检测常见病原19种及犬、猫染色体(表2),以bh、tg、bru阳性临床分离株核酸为阳性对照。结果除阳性对照外,其余病原体模板均为阴性(图5)。
表2常见宠物病原模板
icdc,中国疾病预防控制中心传染病预防控制所。
bmu,北京大学第一医院真菌保藏库。
实施例4荧光pcr体系检测限的评价
检测下限即以已优化的检测方法从一系列倍比稀释的阳性质粒模板中检测,结果为阳性的能力。以梯度浓度(1copies/μl~106copies/μl)的汉赛巴尔通体,刚地弓形虫,布氏杆菌猪种阳性质粒为模板,每个浓度梯度取5μl检测。按照实施例2优化的反应体系和反应条件进行荧光pcr,每个浓度梯度做3个平行样。结果显示,本发明建立的汉赛巴尔通体bh,刚地弓形虫tg,布氏杆菌brh三重荧光pcr体系检测限分别为5、5和50个拷贝(图6)。
实施例5三重荧光pcr体系标准曲线的制作
以标准浓度模板的汉赛巴尔通体,刚地弓形虫和布氏杆菌阳性质粒(106copies/μl)依次进行10倍稀释共计7个浓度梯度,上样标准品各5μl扩增,模板量为5~5×106copies,绘制多重荧光pcr体系的标准曲线(图7)。由图7可知,本发明的三重荧光pcr体系线性关系良好。
实施例6本发明与文献报道的荧光pcr方法比较
使用bh、tg和bru阳性核酸对本发明三重荧光pcr方法与文献报道的bh(参考文献1:real-timeandmultiplexreal-timepolymerasechainreactionsforthedetectionofbartonellahenselaewithincatflea,ctenocephalidesfelis,samples.medicalandveterinaryentomology(2010)24,449–455.),tg(参考文献2:弓形虫taqman—mgb荧光定量pcr检测方法的建立.中国预防兽医学报.2016.vol38,no.9)和bru(参考文献3:多重荧光定量pcr方法鉴定布鲁氏菌属及牛羊种布鲁氏菌研究.中国人兽共患病学报.2012.28(9).)三种单重荧光pcr方法进行比较。
表3
p代表检测阳性,n代表检测阴性
参考文献1报道的bh检测限为25拷贝,申请人按照参考文献1的报道重复该实验,发现其公开的方法可以检测到100拷贝,但是不能检测到10拷贝的bh,说明参考文献1报道的检测限具有可信性。本发明可以检测10拷贝的标本,实际上,在实施例4能检测到5个拷贝,其对bh的检测限优于参考文献1的报道。
参考文献2报道的tg检测限为4.85拷贝,申请人按照参考文献2的报道重复该实验,发现按照其公开的方法可以检测到100拷贝,但是不能检测到10拷贝的tg,说明参考文献2报道的检测限与实际检测限差异较大,可信性不足。本发明的三重pcr方法可以检测tg10拷贝的标本,实际上,在实施例4能检测到5个拷贝,说明本发明tg的实际检测限优于参考文献2的报道。
参考文献3报道的bru检测限约为750拷贝,申请人重复该文献的方法发现其的确不能检测到100拷贝,说明其报道具有可信性,本发明可以检测到100拷贝的标本,实际上,在实施例4能检测到50个拷贝,其bru的检测限优于参考文献3的报道。
序列表
<110>西安博睿康宁生物科技有限公司
<120>检测宠物源性人兽共患病的多重pcr引物探针及试剂盒
<130>khp181118007.7
<160>27
<170>siposequencelisting1.0
<210>1
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>1
cagcgtccatttggttgatataaa24
<210>2
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>2
gaaccgatagtttcatataggcattg26
<210>3
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>3
tccaaatgctcatagacg18
<210>4
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>4
gctcgcctgtgcttgga17
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
gcgtctgtagtccccttcga20
<210>6
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>6
ccacagaagggacagaa17
<210>7
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>7
gcaagggcaaggtggaaga19
<210>8
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>8
gatatggatcgtttccgggtaa22
<210>9
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>9
ttgcgccttctggcgacgc19
<210>10
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>10
cacagaagggacagaagtcgaa22
<210>11
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>11
cagtcctgatatctctcctccaaga25
<210>12
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>12
actacagacgcgatgccgctcctc24
<210>13
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>13
cagaagggacagaagtcgaat21
<210>14
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>14
agtcctgatatctctcctccaa22
<210>15
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>15
gaggagcggcatcgcgtctgtag23
<210>16
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>16
tttacagcgtccatttggttga22
<210>17
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>17
aaccgatagtttcatataggcattga26
<210>18
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>18
ataaattccaaatgctcatagac23
<210>19
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>19
agcgtccatttggttgatataa22
<210>20
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>20
accgatagtttcatataggcattgt25
<210>21
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>21
caaatgctcatagacga17
<210>22
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>22
ctattatccgattggtggtctgatc25
<210>23
<211>16
<212>dna
<213>人工序列(artificialsequence)
<400>23
ccggcacgcccttttc16
<210>24
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>24
cgaacgcgatttccggcgc19
<210>25
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>25
tgcaagggcaaggtggaa18
<210>26
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>26
cgatatggatcgtttccgggta22
<210>27
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>27
gcgccttctggcgacgct18
相关知识
动物源PCR检查 欢迎来电「苏州翊创生物科技供应」
什么情况下猫咪需要进行FeLV检测及如何检测猫白血病病毒
一种猫遗传病SNP位点检测试剂盒的制作方法
宠物源性人兽共患寄生虫病的研究进展
宠物检测试剂盒
动物源性成分肉类检测方法
狂犬病病毒实验室检测方法
上海兽医研究所宠物人畜共患病快速检测技术取得重要突破 技术要闻
POCKIT宠物荧光PCR仪(犬猫传染病检测)
人兽共患病症状
网址: 检测宠物源性人兽共患病的多重PCR引物探针及试剂盒的制作方法 https://m.mcbbbk.com/newsview717247.html
| 上一篇: 海关总署更新“允许进口饲料国家( |
下一篇: 安全与创新并存:动物源性医疗器械 |
